|
Alanina: è un amminoacido non polare, la sua
molecola è chirale (che ammette un'immagine
speculare non sovrapponibile).
Dopo la glicina,
è il più piccolo degli amminoacidi. E’ stato isolato
per la prima volta nel 1879.
Per l'organismo umano è un amminoacido non
essenziale, dato che l'organismo umano è in grado di
sintetizzarla. Può venire infatti prodotta nei
muscoli a partire dall'acido glutammico tramite un
processo chiamato transamminazione. Nel fegato l'alanina
viene trasformata in acido piruvico. Infine,
l'enzima alanina amminotransferasi catalizza la
reazione nella quale il gruppo ammino dell'alanina
viene trasferito all'acido α-chetoglutarico.
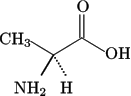
|
| Figura 1 - Struttura
chimica dell'alanina |
Analizzatore: viene usato nella spettrometria
di massa per separare gli ioni in funzione del loro
rapporto massa/carica (m/z).
Esistono diversi tipi
di analizzatore, classificati in funzione del loro
principio di funzionamento:
- Analizzatore magnetico
- Analizzatore a quadrupolo
- Analizzatore a trappola ionica
- Analizzatore TOF
L’analisi attraverso analizzatore magnetico è
prodotta utilizzando campi elettrici e campi
magnetici. Il campo elettrico accelera la velocità
degli ioni , inviandoli in un condotto ricurvo, ed
il campo magnetico induce una flessione del percorso
degli ioni che risultano accelerati in base alla
loro massa.
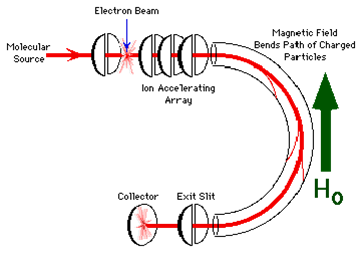
|
| Figura 2 - Principio funzionamento
dell'analizzatore magnetico |
L’analizzatore quadrupolo è un analizzatore ideato
da Wolfgang Paul, per il quale vinse il premio Nobel
ex-aequo per la fisica nel 1989, gli strumenti con
questo tipo di separatore risultano essere più
compatti nelle dimensioni e generalmente meno
costosi di quelli basati sul campo magnetico
statico.
Il flusso di ioni attraversa uno spazio a sezione
quadrata al centro di quattro barre orizzontali
parallele alle cui coppie diagonalmente opposte
vengono applicate correnti continue di segno
opposto. Questo campo elettrico fisso, unito ad un
altro oscillante con frequenze dell'ordine delle
onde radio, fa muovere gli ioni secondo traiettorie
sinusoidali consentendo solo a quelli di una data
massa di attraversare l'intero quadrupolo e giungere
al rivelatore.
La modulazione del segnale radio consente di
scandire l'intero arco delle masse corrispondenti.
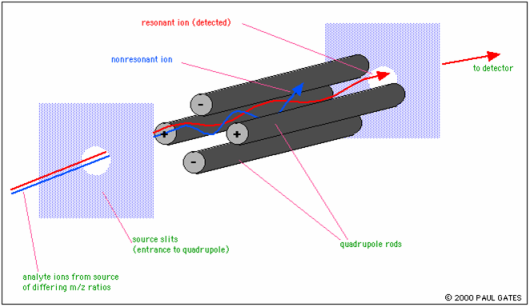
|
| Figura 3 - Principio funzionamento
dell'analizzatore quadrupolo |
La trappola ionica è un analizzatore a quadrupolo
con barre iperboliche piegato su se stesso in modo
da formare un' anello. L'elettrodo centrale (il
"buco della ciambella") è eliminato, ed il voltaggio
continuo ed alternato sono applicati tra l'elettrodo
esterno e gli elettrodi inferiore e superiore, che
diventano due superfici convesse. Due piccoli buchi
sugli elettrodi inferiore e superiore permettono la
introduzione e l'uscita degli ioni. E’ possibile
intrappolare per un tempo lungo a piacere gli ioni e
farli frammentare grazie alla presenza di un gas.
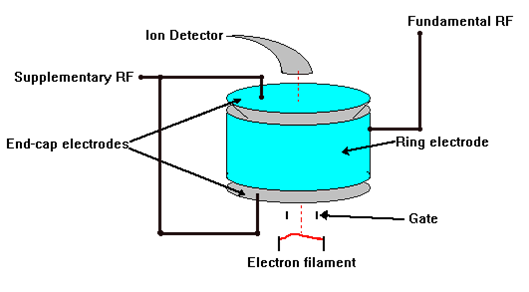
|
| Figura 4 - Struttura di una trappola ionica |
Cellula: è l'unità
fondamentale di tutti gli organismi viventi (con
l'eccezione dei virus). Le sue
principali caratteristiche sono di essere in grado
di vivere autonomamente e soprattutto di riprodursi.
Se si pensa all’evoluzione della vita sulla Terra,
si può considerare la cellula come la struttura
all’interno della quale i processi chimico-fisici
che hanno dato origine alle molecole biologiche, e
che sono alla base delle attività vitali, sono
potuti avvenire in modo regolare e ordinato. La
capacità di produrre reazioni ordinate e regolari è
stata necessaria affinché tali reazioni potessero
ripetersi in maniera identica, fornendo un primo
esempio di fenomeno riproducibile.
Vi sono due tipi
di cellule: le procariote, con una struttura molto
semplice, senza nucleo; e le eucariote, nelle quali
il materiale genetico all’interno della cellula è
raccolto in un nucleo, racchiuso in un involucro che
lo separa dalla restante parte, detta citoplasma.
Sono eucariote tutte le cellule animali e vegetali.
Ci riferiremo a un eucariote quindi come a una
"cellula tipo" con caratteristiche funzioni
fondamentali comuni a tutte le cellule umane.
Durante l’evoluzione della vita, l’associazione e la
cooperazione fra cellule è risultata vantaggiosa,
dando origine a organismi a più cellule. Da qui la
necessità per le cellule di differenziarsi per
svolgere funzioni diverse; all’interno dello stesso
organismo troveremo quindi cellule molto diverse fra
loro come struttura, dimensioni e forma a seconda
delle funzioni che svolgono. Tutte queste cellule
sono però riferibili al modello generale della
cellula eucariote. La cellula eucariota ha un volume
maggiore rispetto a quella procariotica e contiene
una serie di strutture dette organelli, o organuli. Una
caratteristica delle cellule è di avere una
membrana, detta plasmatica o cellulare, che le
delimita rispetto all’ambiente esterno e conferisce
loro identità. Vi è poi il materiale genetico (DNA)
organizzato in cromosomi e contenuto nel nucleo, che
è una struttura anch’essa delimitata da una membrana
nucleare.
Il rimanente contenuto cellulare è detto citoplasma:
nel suo interno si trovano organelli, come i
mitocondri o i centrioli, immersi in una sostanza
gelatinosa, il citosol Il citoplasma è separato in
differenti scomparti da un sistema di membrane
interne che delimitano strutture con funzioni
specializzate come il reticolo endoplasmatico,
l'apparato del Golgi, lisosomi e perossisomi.
Effetto induttivo: (o effetto di campo
induttivo) in chimica è la capacità che un atomo
o un gruppo funzionale ha di stabilizzare o
destabilizzare una molecola, un radicale o uno ione
tramite la propria elettronegatività.
Elio: l'elio è l'elemento chimico della
tavola periodica degli elementi che ha come simbolo He e come numero atomico 2. E’ un gas nobile incolore
e inodore; ha il più basso punto di ebollizione fra
tutti gli elementi e può solidificare solo se
sottoposto ad altissime pressioni. Si presenta come
gas monoatomico ed è chimicamente inerte. E’ il
secondo elemento più diffuso nell'universo, dopo
l'idrogeno.
Tracce di elio, dovute al decadimento di certi
minerali, sono presenti nell'atmosfera terrestre;
l'elio si trova inoltre in alcune acque minerali e,
in quantità economicamente sfruttabili, anche in
alcuni gas naturali. E’ usato nei palloni
aerostatici, come liquido refrigerante per i magneti
superconduttori e come gas nelle miscele per le
immersioni di profondità.
Genoma: o patrimonio genetico, è l'insieme dei geni di un organismo vivente.
Genomica: La genomica è una branca della biologia
molecolare che si occupa dello studio del genoma degli organismi viventi.
In particolare si occupa della struttura, contenuto, funzione ed evoluzione
del genoma. è una scienza che si basa sulla bioinformatica per l'elaborazione
e la visualizzazione dell'enorme quantità di dati che produce.
La genomica nacque negli anni 80, quando furono prese le prime
iniziative per il sequenziamento di interi genomi. Tra gli obiettivi che si pone
la genomica vi è dunque l'allestimento di complete mappe genetiche e fisiche
del DNA degli organismi viventi, proseguendo con il suo completo sequenziamento.
La sequenza del DNA viene poi annotata, ovvero vengono identificati e
segnalati tutti i geni e le altre porzioni di sequenza significative, insieme a
tutte le informazioni conosciute su tali geni. In questo modo è possibile ritrovare
in maniera organizzata ed efficace le informazioni in appositi database, normalmente
accessibili via Internet gratuitamente. Grazie al sequenziamento di diversi genomi è nata
la genomica comparativa, che si occupa del confronto tra i genomi di diversi organismi,
nella loro organizzazione e sequenza.
Glicerolo: il glicerolo, noto anche col nome
di glicerina è un triolo, ovvero un composto
organico nella cui struttura sono presenti tre
gruppi -OH.
A temperatura ambiente è un liquido incolore
piuttosto denso e viscoso; la presenza di tre gruppi
-OH lo rende miscibile con l'acqua in ogni
proporzione.
Trova impiego nella produzione di saponi, sciroppi,
creme per uso farmaceutico e cosmetico, nonché come
additivo alimentare, identificato dalla sigla E422.
E’ anche un reagente usato nella sintesi di composti
organici più complessi.
Il glicerolo è un componente dei lipidi (oli e
grassi) e dei fosfolipidi, dai quali viene ottenuto
per idrolisi o transesterificazione (trasformazione
di un estere in un altro estere per reazione con un
alcol). Quando
l'organismo utilizza le sue riserve di grasso,
dapprima le scinde in acidi grassi e glicerolo,
quest'ultimo viene trasformato nel fegato in
glucosio diventando una fonte di energia per il
metabolismo cellulare.
Il glicerolo è anche un sottoprodotto della
produzione del biodiesel.
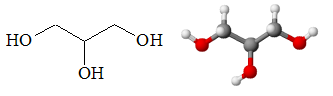
|
| Figura 5 - Struttura
chimica del glicerolo |
Ione: in chimica, una molecola o un atomo
elettricamente carichi vengono detti ioni. Poiché
hanno perso o guadagnato uno o più elettroni
rispetto al normale, il processo di
perdita/acquisizione viene detto ionizzazione.
Gli ioni caricati negativamente sono conosciuti come
anioni (che sono attratti dagli anodi) e quelli
caricati positivamente sono chiamati cationi (e sono
attratti dai catodi). Gli ioni possono essere
monovalenti (indicati con una + o -), bivalenti
(con due + o -) e trivalenti (con tre +). Poi gli ioni
si dividono in monoatomici e poliatomici.
La parola "ione" deriva dal greco ion, participio
presente di ienai "andare", quindi "andante".
"Anione" e "catione" significano "andante in su" e
"andante in giù", mentre "anodo" e "catodo" significano
"verso l'alto" e "verso il basso" (hodos = strada, via).
Ninidrina: la ninidrina (o
2,2-diidrossi-1,3-diossoidrindene) è un indicatore
specifico per il rilevamento degli amminoacidi.
Reagisce con essi (esclusa la prolina) sviluppando
una intensa colorazione viola.
A temperatura ambiente, si presenta come un solido
giallo chiaro dall'odore tenue caratteristico. La
ninidrina reagisce con il gruppo amminico
dell'amminoacido libero; la reazione è veloce ma,
talvolta, per velocizzare è necessario il
riscaldamento per pochi minuti. E’ un composto
nocivo, irritante.
Reagendo con gli amminoacidi contenuti nelle
secrezioni eccrine (sudore), consente di rilevare le impronte
digitali lasciate su superfici porose (carta,
tessuto, legno), che sviluppano la tipica
colorazione violetta. In genere, la superficie viene
spruzzata con una soluzione di ninidrina in acetone
o freon (gas derivati dal metano e dall'etano).
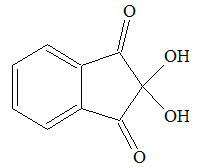
|
| Figura 6 - Struttura chimica della ninidrina |
pH: il pH (dal latino pondus hydrogenii) è
una scala di misura dell'acidità di una soluzione
acquosa. Questo concetto fu ideato dal chimico
danese Soren Sorensen nel 1909.
Il termine p (operatore) simboleggia due operazioni
matematiche da operare sulla concentrazione
idrogenionica [H+] o, più correttamente,
sull'attività dello ione idrogeno in soluzione
acquosa. Le due operazioni sono: il logaritmo in
base 10 della concentrazione espressa in moli/litro
e quindi il cambio di segno del risultato
(moltiplicazione per -1).
Pertanto, si definisce come pH = -log10aH+
in cui aH+ rappresenta l'attività degli ioni
idrogeno, che coincide con la concentrazione molare
dei medesimi in soluzioni acquose sufficientemente
diluite (≤ 0,1 mol/l), pertanto: pH = -log10[H+]
Il pH solitamente assume valori compresi tra 0
(acido forte) e 14 (base forte). Al valore
intermedio di 7 corrisponde la condizione di
neutralità, tipica dell'acqua pura a 25°C.
Il pH può essere misurato per via elettrica,
sfruttando il potenziale creato dalla differenza di
concentrazione di ioni idrogeno su due lati di una
membrana (si veda piaccametro), o per via chimica,
sfruttando la capacità di alcune sostanze (dette
indicatori) di modificare il loro colore in funzione
del pH dell'ambiente in cui si trovano. Normalmente,
sono sostanze usate in soluzione, come per esempio
la fenolftaleina e il blu di bromotimolo.
Molto spesso gli indicatori si usano anche
supportati su strisce di carta (le cosiddette
"cartine indicatrici"), le quali cambiano colore
quando vengono immerse in sostanze acide o basiche.
L'esempio più comune è quello delle "cartine al
tornasole", di colore rosa in ambiente acido e
azzurro in ambiente alcalino.
pK: è il logaritmo negativo della costante di
dissociazione di un composto (K):
pK = − logK =
log(1 / K), la costante di dissociazione di
un elettrolita è il rapporto tra il prodotto delle
concentrazioni degli ioni che si hanno dalla
dissociazione di una molecola e la concentrazione
della frazione indissociata della molecola stessa,
una volta che si è raggiunto l'equilibrio ad una
data pressione e temperatura.
Proteoma:
termine coniato nel 1994 da Mark Wilkins che descrive l’
insieme delle proteine di un organismo o di un sistema biologico,
ovvero le proteine prodotte dal genoma.
Si può considerare il proteoma completo di un organismo
come l'insieme globale delle proteine
di tutti i proteomi cellulari.
Spettro: lo spettro
rappresenta normalmente un istogramma che
riporta l'abbondanza (il valore della massa di
un composto in riferimento alla sua carica cioč
m/z) di ogni ione in funzione della sua massa ipotizzando che tutti gli ioni prodotti dall'analisi abbiano carica singola.
Spettrofotometro/spettrometro: è un dispositivo per
la misura dell'intensità luminosa, che può
determinare l'intensità come funzione del colore, o
in termini più fisici, della lunghezza d'onda della
radiazione luminosa. Sono disponibili molti generi
di spettrofotometri. Tra le distinzioni più
importanti adottate per classificarli vi sono gli
intervalli di lunghezze d'onda nei quali operano, le
tecniche di misurazione che adottano, le modalità
secondo le quali acquisiscono uno spettro e le
sorgenti dell'intensità luminosa variabile per la
cui misura sono stati progettati. Altri aspetti
importanti degli spettrofotometri includono la loro
banda spettrale e il loro intervallo di linearità.
L'applicazione forse più comune degli
spettrofotometri è la misurazione dell'assorbimento
luminoso, ma essi possono essere progettati anche
per misurare la riflettanza diffusa o speculare. In
termini strettamente fisici, anche la mezza
emissione di uno strumento a luminescenza
costituisce una specie di spettrofotometro.
Vi sono due maggiori categorie di spettrofotometri;
quelli a fascio singolo e quelli a fascio doppio.
Uno spettrofotometro a fascio doppio misura il
rapporto dell'intensità luminosa di due diversi
percorsi della luce, mentre uno spettrofotometro a
fascio singolo misura una intensità luminosa
assoluta. Sebbene le misure di rapporti siano più
facili, e in genere più stabili, gli strumenti a
fascio singolo presentano dei vantaggi; ad esempio
possono avere degli intervalli dinamici più estesi.
Distinguiamo:
-
Spettrofotometri della
regione del visibile
-
Spettroradiometri
-
Spettrofotometri UV e IR
La spettrofotometria
della regione del visibile, tra ca. 400 e ca.
700 nm, viene usata estesamente nella colorimetria
scientifica. I produttori di inchiostri, le aziende
della stampa, i produttori di tessili e molte altri
tipi di imprese necessitano di dati ottenibili
attraverso la colorimetria. Solitamente, nella
spettrofotometria del visibile si effettuano
misurazioni ad intervalli di lunghezza d'onda di 10
nanometri e si produce una curva di riflettanza
spettrale. Queste curve possono essere utilizzate
per controllare i lotti di coloranti per verificare
se soddisfano i requisiti specifici. Gli
spettrofotometri del visibile tradizionali non
riescono a rilevare se un colorante presenta
fluorescenza. Questo rende loro impossibile operare
correttamente sui colori quando qualcuno degli
inchiostri da stampa analizzato è fluorescente. Per
i coloranti che presentano fluorescenza occorre
usare uno spettrometro fluorescente bispettrale.
Sono disponibili due assetti principali per gli
spettrofotometri per lo spettro visibile chiamati
rispettivamente d/8 o sferici e 0/45. Questi termini
sono derivati dalla geometria della sorgente
luminosa, dell'osservatore e dell'interno della
camera di misurazione.
Gli spettroradiometri
sono apparecchiature che operano in modo molto
simile agli spettrofotometri per la regione delle
radiazioni visibili e sono designati a misurare le
distributioni della potenza spettrale di dispositivi
ed impianti di illuminazione; i costruttori li usano
per valutare e categorizzare i dispositivi che
pongono in vendita e i loro clienti per garantire
che quanto acquistano soddisfi le loro esigenze.
Gli spettrofotometri
più comuni sono usati nelle regioni UV e visibile
dello spettro; alcuni di questi strumenti operano
altrettanto bene nella regione dell'infrarosso
vicino. Gli spettrofotometri progettati per la
regione principale dell'infrarosso sono molto
differenti, a causa delle esigenze tecniche delle
misurazioni in questa parte dello spettro. Uno dei
fattori principali è il tipo di fotosensori che sono
efficaci nelle diverse regioni spettrali, ma le
misurazioni nell'infrarosso risultano impegnative
anche perché virtualmente tutti gli oggetti emettono
radiazioni IR in conseguenza di fenomeni termici,
specialmente a lunghezze d'onda superiori ai 5 μm.
Molti spettrofotometri per analizzare lo spettro
usano un monocromatore a prisma o a reticolo; sono
però disponibili anche spettrofotometri che usano
sequenze di fotosensori e, specialmente
nell'infrarosso, vi sono spettrofotometri che
utilizzano una tecnica di trasformata di Fourier
(rappresentazione di un segnale in termini di
frequenze e relative ampiezze) per
acquisire le informazioni spettrali; tale tecnica è
conosciuta con la sigla FTIR.
Lo spettrofotometro misura quantitativamente la
frazione di luce che attraversa una determinata
soluzione. In uno spettrofotometro, una luce
proveniente da una lampada nella regione vicino-IR/VIS/UV
(tipicamente una lampada a scarica in gas deuterio
(isotopo stabile dell'idrogeno il cui nucleo è
composto da un protone e un neutrone) per l'UV/VIS e particolari lampade ad incandescenza
per l'IR) viene guidata attraverso un monocromatore
che separa dallo spettro complessivo la radiazione
di una particolare lunghezza d'onda. Questa luce
passa attraverso il campione che deve essere
sottoposto alla misurazione. Attraversato il
campione, l'intensità rimanente della radiazione
viene misurata mediante un rivelatore costituito da
un fotodiodo (è un particolare tipo di sensore
ottico in grado di riconoscere una determinata
lunghezza d'onda e di trasformare questo evento in
un segnale elettrico di corrente) o da un altro sensore luminoso; questo
consente di calcolare la trasmittanza (la frazione
di luce incidente ad una data lunghezza d'onda che
attraversa un campione) della
lunghezza d'onda in esame.
Mentre gli assorbimenti di lunghezze d'onda che
cadono nell'ambito dell'UV/VIS danno luogo a
variazioni di energia elettronica, gli assorbimenti
nella regione infrarossa sono invece legati a
variazione dell'energia vibrazionale delle molecole.
Tali effetti, che stanno alla base di una misura
spettrofotometrica, vengono comunemente sfruttati in
chimica per determinazioni qualitative, quantitative
ed inerenti lo studio della struttura e legame
chimico.
Risonanza: in chimica, si ha risonanza quando
più formule, dette formule limite, concorrono a
definire la vera struttura di una molecola.
Viene simbolizzata con una freccia a due punte.
La risonanza è un grande fattore di stabilità sia
per le molecole, che per i radicali, che per gli
ioni. Attraverso la risonanza un radicale o uno ione
vengono stabilizzati per via della dispersione della
carica elettrica o della delocalizzazione
dell'elettrone spaiato che ne consegue.
|